Danni al DNA e difetti di riparazione del DNA associati alla malattia e all’invecchiamento precoce
Il codice genetico è costantemente attaccato da agenti dannosi interni ed esterni, come specie reattive dell’ossigeno, radiazioni atmosferiche, sostanze chimiche ambientali e chemioterapici. Se le modificazioni del DNA persistono, possono portare a difetti di replicazione o all’arresto della trascrizione dell’RNA, oppure possono fungere da modelli mutageni durante le reazioni di sintesi degli acidi nucleici. Per combattere le conseguenze deleterie del danno al DNA, gli organismi hanno sviluppato complesse reti di riparazione che rimuovono le modifiche chimiche o le disposizioni alterate delle basi azotate che compongono la catena del DNA e ripristinano il genoma al suo stato originale. Non sorprende che difetti ereditari o sporadici nei meccanismi di riparazione del DNA possano dare origine a esiti cellulari che sono alla base di malattie da trasformazione e invecchiamento.
Diversi processi biochimici essenziali generano specie reattive dell’ossigeno (ROS) o altri agenti dannosi intracellulari che sfidano l’integrità del genoma di un organismo aerobico. Questi processi includono, in particolare, la respirazione mitocondriale, che produce energia chimica sotto forma di ATP che alimenta molte operazioni cellulari. Diverse genotossine endogeni metabolici, i molti agenti chimici ambientali e radiazione di fondo, ogni giorno possono generate lesioni al DNA in ogni genoma di mammifero con conseguenze negative delle modificazioni indesiderate del DNA.
Il nostro materiale genetico è una macromolecola fondamentale che deve essere mantenuta e preservata in modo tempestivo ed efficiente. In particolare, il danno al DNA può bloccare il meccanismo di replicazione o trascrizione, portando a risposte mutagene o di stress. Ad esempio, le cellule potrebbero aggirare erroneamente una lesione codificata in modo errato o distribuire transitoriamente DNA polimerasi a bassa fedeltà per superare il danno persistente al DNA, scegliendo la mutagenesi sulla morte cellulare. Tali eventi mutazionali possono portare all’inattivazione dei geni oncosoppressori o all’attivazione di oncogeni, innescando il processo cancerogeno. In alternativa, la replicazione indotta dalla lesione o l’arresto della trascrizione possono perturbare l’omeostasi cellulare, spesso promuovendo l’attivazione delle risposte di morte cellulare (Apoptosi) . Data l’importanza di rimuovere il danno al DNA dal genoma e sostenere l’integrità genomica, gli organismi hanno sviluppato intricati sistemi interdipendenti che coinvolgono i percorsi dei punti di controllo del ciclo cellulare, la risposta al danno al DNA (DDR) e meccanismi di riparazione del DNA. La carenza in questi processi è associata a una serie di malattie, tra cui predisposizione al cancro, neurodegenerazione e invecchiamento precoce.
Panoramica sulla formazione e conseguenze del danno al DNA
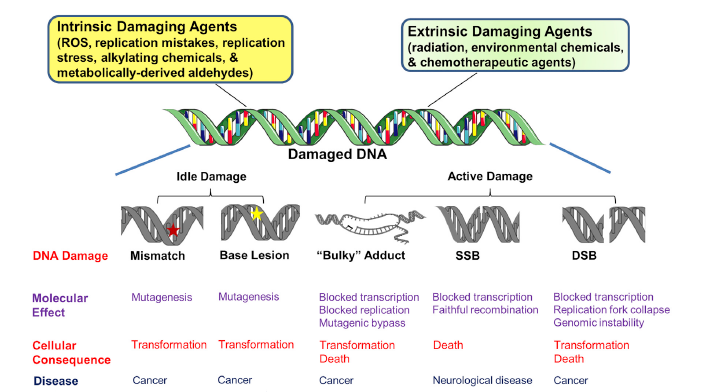
Coppie di basi alterate possono determinare esiti mutageni e possono alterare le proprietà codificanti del genoma, con alterazione delle proteine da produrre , variazioni epigenetiche, possono verificarsi errori di ripetizione di tratti di basi inducendo inserzioni o duplicazioni
Un’altra importante fonte intrinseca di danno al DNA sono i ROS, che vengono generati durante la respirazione mitocondriale o attraverso reazioni di Fenton a base di metalli. I ROS, inclusi il superossido, il perossido di idrogeno, i radicali idrossilici e l’ossigeno singoletto, possono produrre direttamente basi danneggiate ossidativamente e rotture a filamento singolo del DNA.
Alcune delle più comuni modificazioni della base ossidativa includono 8-ossoguanina (8-oxoG), un biomarcatore dello stress ossidativo che causa pochi cambiamenti ma importanti.
L’attacco dei ROS all’anello zuccherino(desossiribosio) nel DNA può anche portare alla formazione diretta di interruzioni nella catena del DNA
Il danno ad altre macromolecole cellulari (oltre al DNA) da parte dei ROS endogeni può produrre ulteriori forme di genotossine intracellulari. Ad esempio, la perossidazione lipidica può produrre malondialdeide, che può reagire con basi del DNA per generare addotti voluminosi, creando alterazioni strutturali nel DNA, che hanno la capacità di inibire il meccanismo di replicazione o trascrizione.
La perossidazione degli acidi grassi polinsaturi nelle membrane cellulari genera un’importante aldeide che può reagire con tutte e quattro le basi del DNA, in particolare con la guanina.
Agenti dannosi estrinseci
Alcune delle principali minacce dannose per il DNA includono radiazioni ultraviolette (UV) o ionizzanti (IR), numerose sostanze chimiche ambientali e agenti chemioterapici. Un’esposizione ambientale quasi inevitabile è la radiazione atmosferica. La radiazione UV è infatti uno dei rischi per la salute più significativi per l’uomo, causando lievi ustioni cutanee o, in casi estremi, cancro della pelle.
Mentre gli UV-C sono assorbiti principalmente dall’atmosfera terrestre, le radiazioni UV-A e UV-B costituiscono il componente dannoso primario dello spettro UV solare, producendo fotolesioni del DNA.
Le fotolesioni causano lievi alterazioni strutturali dell’elica del DNA che possono promuovere mutazioni che sono alla base del melanoma
Le radiazioni ionizzanti producono un ampio spettro di danni al DNA, sia attraverso la ionizzazione diretta che indirettamente attraverso la produzione di ROS
Altri agenti esterni dannosi per il DNA si incontrano per caso o per abitudini di vita, tra questi il fumo di sigaretta che contiene nicotina, le aldeidi (formaldeide), gli idrocarburi (benzene), metalli e composti inorganici (arsenico), e molti altri che sono noti cancerogeni per l’uomo.
Collettivamente, le modifiche al genoma, comunque introdotte, hanno il potenziale per cambiare le proprietà codificanti del DNA, portando a mutagenesi, instabilità genomica o attivazione di vari destini cellulari, come apoptosi, necrosi o senescenza.
Il DNA ha in sè la capacità di riparare i danni che si producono continuamente nel DNA.
Alcuni individui presentano delle varianti geniche, coinvolte nella capacità di riparo, che alterano e diminuiscono questa capacità intrinseca della persona a riparare i danni che continuamente avvengono nel DNA, ponendo le basi per la predisposizione al cancro, alla malattia neurologica e all’invecchiamento precoce.
Lesioni del DNA complesse che causano disturbi ai processi di trascrizione o replicazione promuoverebbero esiti cellulari, come morte cellulare e provocando patologie degenerative o di invecchiamento accelerato dando origine a patologie cliniche associate.
Le cellule invecchiano precocemente o perché presentano una predisposizione genetica ad una diminuita capacità di riparo , o perché accumulano difetti durante il loro ciclo vitale e contemporaneamente diminuiscono la loro capacità di difesa.
Un esempio sono le mutazioni nei geni BRCA1 o BRCA2 coinvolti nelle forme ereditarie comuni di cancro al seno e alle ovaie e che danno luogo a una pronunciata instabilità cromosomica.
Attualmente si ritiene che le maggiori patologie neurologiche siano legate all’invecchiamento cellulare.
Anche l’infertilità può essere coinvolta nella capacità di riparo del DNA e in particolare nel maschio i gameti non possiedo sistemi di riparo per cui processo di riparazione resta a carico dei gameti femminili (ovociti) che suppliscono con i loro sistemi di riparo ai danni eventuali maschili , una volta che è avvenuta la fecondazione. Ma se gli ovociti delle donne sono “vecchi” per l’età femminile avanzata, questo aiuto tende a venir meno diminuendo le possibilità di una corretta fecondazione.
I difetti di riparazione del DNA sono stati associati a molte altre malattie, tra cui degenerazione maculare, malattie cardiovascolari, artrosi, diabete, demenza .
DA The American Journal of Human Genetics 105, 237–257, August 1, 2019


